Kurzdefinition: Synapsen sind die Verbindungen oder spezialisierte Verknüpfungen, über die Informationen im Nervensystem übertragen werden, wo eine Nervenzelle an eine andere andockt. Die Kommunikation zwischen Nervenzellen läuft über diese Synapsen, wobei ein ankommendes elektrisches in ein chemisches Signal umgewandelt wird. Das ankommende Signal erzeugt eine Spannungsänderung, die über spezielle Kanäle Kalzium einströmen lässt, das an Kalziumsensoren bindet, die wiederum in kleine Bläschen verpackte Neurotransmitter in Bewegung setzen, die im synaptischen Spalt freigesetzt werden und schließlich die benachbarte Zelle erreichen, wo sie an spezielle Rezeptoren binden, die dieses chemische Signal schließlich wieder in ein elektrisches umwandeln. Siehe dazu Gehirn-Neuronen
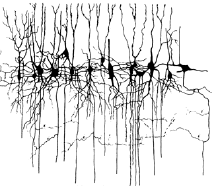
Synapsen sind demnach die Kontaktstellen zwischen Nervenzellen und anderen Zellen wie Sinnes-, Muskel- oder Drüsenzellen oder auch zwischen Nervenzellen untereinander. An ihnen findet die Erregungsübertragung von einem Axon auf eine andere Zelle statt. Der Begriff Synapse wurde im Jahre 1897 von Charles S. Sherrington geprägt. Eine Synapse ist quasi das WhatsApp der Nervenzellen, wobei ihr Text aus chemischen Botenstoffen wie Dopamin oder Serotonin besteht. Synapsen bilden die Grundlage für eine Kommunikation zwischen den einzelnen Neuronen und damit auch Grundlage für neuronale Netzwerke. Synapsen bestehen aus einem synaptischen Spalt, einer Lücke zwischen dem Axon des einen Neurons und einem Dendriten eines anderen Neurons, der Präsynapse, also jener Teil vor dem synaptischen Spalt, wo kleine Bläschen bereit liegen, die mit dem jeweiligen Botenstoff der Nervenzelle gefüllt sind, und der Postsynapse, die hinter dem synaptischen Spalt liegt. Ein Beispiel für eine Kommunikation, bei der nur eine einzige Synapse im Spiel ist, ist der Kniesehnenreflex, denn trifft die Handkante oder ein Reflexhammer auf die Kniesehne, werden die Sehne und der daran hängende Oberschenkelmuskel minimal gedehnt. Ein Sensor im Muskel nimmt diese Dehnung auf und sendet die Information über eine Synapse direkt an die Nervenzelle, die den Oberschenkelmuskel anspannen lässt. Wenn an einem Reflex nur eine einzige Synapsebeteiligt ist nennt man diesen auch monosynaptischen Reflex.
An den Synapsen wird das elektrische Signal von der einen zur anderen Zelle weitergereicht bzw. fungieren häufig genutzte Synapsen wie Verstärker, wobei selbst sehr schwache Eingangssignale zu einer starken Erregung der Nachbarzelle führen können. Diese Fähigkeit müssen Synapsen jedoch erst erlernen: Eine Synapse besteht im Prinzip aus einer Zuleitung (dem Axon), die durch einen schmalen Spalt von einer ableitenden Faser (dem Dendriten) getrennt ist. Jeder elektrische Reiz läuft vom Zellkörper über das Axon bis zum synaptischen Spalt. Dort führt er zur Ausschüttung chemischer Botenstoffe. Diese durchqueren den Spalt und docken an den Dendriten an. Der Dendrit erzeugt als Reaktion ein elektrisches Signal und leitet es weiter. Wie viel Botenstoffe an der Synapse ausgeschüttet werden, hängt von ihrem Trainingszustand ab: Bei häufiger Reizung kann sie so umgebaut werden, dass sie auf einen Schlag große Mengen dieser Neurotransmitter freisetzen kann. Forscher der Universität Bonn um Heinz Beck konnten zeigen, dass für den Umbau der Synapse nicht nur die regelmäßige lokale Stimulierung verantwortlich ist, sondern der Umbau hängt auch ganz entscheidend von der Reizung des einige Millimeter entfernten Zellkörpers ab. Wenn man ausschließlich den Zellkörper oder alternativ ausschließlich die Synapse zu reizt, gibt es keinen nachhaltigen Trainingseffekt, wenn jedoch sowohl Zellkörper als auch Synapse regelmäßig elektrisch gereizt wurden nahm die Kontaktfreude der Nervenzelle dauerhaft zu.
Informationsübertragung
Die Informationsübertragung an der Synapse zwischen Neuronen ist eine hochkomplexe, aber gleichzeitig äußerst schnelle Serie von Ereignissen. Wenn eine Spannungsänderung (Aktionspotential) das synaptische Terminal im präsynaptischen Neuron erreicht, strömt Kalzium durch spannungsabhängige Kalziumkanäle in das präsynaptische Neuron. Dieser Kalziumeinstrom führt zu einem Anstieg der intrazellulären Kalziumkonzentration. Kalzium bindet dann an Kalziumsensoren im präsynaptischen Terminal, was wiederum die Ausschüttung von Neurotransmitter-gefüllten Vesikeln in die Synapse auslöst. Der freigesetzte Neurotransmitter bindet an postsynaptische Rezeptoren, und führt so zu einer Reaktion des postsynaptischen Neurons. Die Kopplung zwischen Kalziumkanälen und Sensoren der Exozytose ist entscheidend, um Geschwindigkeit, Zeitpunkt und Wahrscheinlichkeit der synaptischen Übertragung zu bestimmen. Zwei Formen der Kopplung treten im Gehirn auf: In der engen oder Nanodomänen-Kopplung liegen Kanäle und Sensoren sehr eng bei einander, in einer Distanz von 10 bis 20 Nanometern, während in der losen oder Mikrodomänen-Kopplung dagegen Kanäle und Sensoren weiter voneinander entfernt liegen, sogar mit einer Distanz von ungefähr 100 Nanometern oder darüber. Forschungsergebnisse legten bisher nahe, dass die lose Kopplung in Synapsen im Verlauf der frühen Entwicklung auftritt, während enge Kopplung im entwickelten Zentralnervensystem beobachtet wird, doch neuere Untersuchungen stellen die lose Kopplung als Entwicklungsphänomen in Frage, und zeigen stattdessen, dass Kopplung eher synapsenspezifisch reguliert ist. Lose Kopplung wird hauptsächlich bei dynamischen und plastischen Synapsen verwendet, sowohl im sich entwickelnden wie im adulten Gehirn. Gemeinsam mit schnellen endogenen Kalziumpuffern kann lose Kanal-Sensor-Kopplung das molekulare Rahmengerüst für präsynaptische Plastizität darstellen, einer Kerneigenschaft synaptischer Kommunikation im Hippocampus. Solche Forschungsergebnisse zeigen, dass aufgrund von loser Kopplung schnell agierende, endogene Kalziumpuffer in der Synapse als Bremse der Signalübertragung dienen können, und so die Wahrscheinlichkeit einer ersten Freisetzung von Neurotransmittern kontrollieren. Lose Kopplung gibt endogenen Puffern die Zeit, um synaptische Übertragung zu beeinflussen. Die Sättigung endogener Puffer nach wiederholter Stimulierung könnte auch die Bahnung fördern, also das Phänomen, durch welches Impulse Aktionspotentiale eher generieren, wenn sie einem vorherigen Impuls knapp folgen.
Der Physiker Thomas Heimburg postuliert übrigens, dass Nervenzellen nicht elektrisch feuern, sondern mechanisch, denn die Signalübertragung erfolgt nach seiner Ansicht durch Druckwellen, die entlang der Nervenzellmembran laufen. Er beruft sich dabei auf vergessene Experimente, die eine kurzfristige Dehnung der Nervenzellen während eines durchlaufenden Aktionspotenzials nachgewiesen hatten. Viele Neurobiologen gestehen zwar zu, dass mechanische Wellen während der Nervenzellreizung auftreten könnten, doch welche Rolle dies für die Signalübertragung spielt, ist aber unklar. Möglicherweise sind die mechanischen Druckwellen nur Folgeerscheinungen der elektrischen Impulse.
Da der Zellkörper unter anderem das genetische Material der Nervenzelle enthält, vermutet man, dass durch die regelmäßige elektrische Reizung Erbinformationen gezielt eingeschaltet werden, sodass der Zellkörper dann vermehrt Proteine produziert, die für die synaptische Funktion wichtig sind, wobei diese Proteine dann über eine Art Schienennetz innerhalb der Zelle zur Synapse gelangen. Wenn man dieses Schienennetz zerstört, büßen die Synapsen daraufhin ihre Lernfähigkeit ein. Allerdings weiß man noch nicht, welche Proteine aus dem Zellkörper für diesen Trainingseffekt verantwortlich sind. Um neue Informationen verarbeiten und speichern zu können oder um bestehende Verarbeitungswege zu optimieren, wachsen daher von der Oberfläche der Nervenzellen ständig winzige Fortsätze auf ihre Nachbarzellen zu, wobei am Ende dieser kleinen Fortsätze eine Synapse entstehen kann, über die in der Folge diese zwei Nervenzellen Informationen austauschen. Noch im erwachsenen Gehirn organisieren sich Nervenzellen selbstständig um, damit sie kontinuierlich Informationen verarbeiten können. Für eine optimale Verarbeitung im Gehirn ist jedoch nicht nur die Weitergabe von Informationen wichtig, sondern auch das gezielte Hemmen des Informationsflusses an bestimmten Stellen, sodass zwei Arten von Synapsen unterschieden werden können: Erregende Synapsen geben Informationen zwischen Zellen weiter, während hemmende Synapsen den Informationsfluss begrenzen. Auch bei einer Umorganisation des Gehirns, etwa auf Grund von Läsionen, bleibt das Verhältnis zwischen Erregung und Hemmung gleich. Offensichtlich versucht das Gehirn, ein Gleichgewicht zwischen Hemmung und Erregung stets aufrecht zu halten.
Genetische Vorprogrammierung
Die Hirnforschung hat gezeigt, dass im Gehirn eine große Anzahl an Synapsen genetisch vorprogrammiert ist, sodass bei Kindern zunächst ein Überangebot an Synapsen zur Verfügung steht, um die ersten großen Mengen an neuen Erfahrungen nach der Geburt und in den ersten Lebensmonaten im Gehirn zu verankern. Alles was ein Kind in dieser Zeit als nützlich und brauchbar empfindet, stabilisiert sich im Gehirn in den dabei verwendeten Verschaltungen, während ungenutzte Areale allmählich verkümmern. Genetisch bestehen daher enorme Lernpotenziale und die Umweltbedingungen, in denen ein Kind lebt, bestimmen wesentlich mit, ob diese Potenziale genutzt werden oder nicht. Die Sprache hat dabei für die synaptisch bedingte Intelligenzentwicklung eine Schlüsselrolle, weil die Bezeichnungen für Gegenstände, Situationen und alles Erlernte wesentlich dabei helfen, Neues im Bewusstsein stabil zu verankern. Zwar können sich Menschen bekanntlich an die Zeit vor ihrem dritten Lebensjahr nicht bewusst erinnern, da in dieser Phase noch nicht genug Worte zur Verfügung stehen, um das Erlernte dauerhaft im Bewusstsein zu verankern, aber viele frühe Erfahrungen sind unbewusst durch Bilder, Gerüche, Töne und Ähnliches geprägt und in dieser oft emotional geprägten Form gespeichert.
Es ist bekannt, dass es während der frühen Gehirnentwicklung kritische Phasen gibt, in denen das Gehirn besonders plastisch ist und individuelle Erfahrungen dazu führen, dass neuronale Schaltkreise neu organisiert und angepasst werden. In sich entwickelnden Gehirnen findet man häufig stille Synapsen, die helfen, die Verbindungen zwischen den Hauptneuronen funktionell zu optimieren. Yusifov et al. (2021) hatten schon vorher herausgefunden, dass die Reifung stiller Synapsen das postsynaptische Dichteprotein-95 (PSD-95) benötigt und frühe kritische Perioden abschließt, jedoch sind die spezifischen Prozesse, die bestimmen, ob synaptische Verbindungen erfahrungsabhängig erhalten oder abgebaut werden, noch weitgehend unbekannt sind. Um dies zu untersuchen, bildete man Neuronen aus der Sehrinde der Maus vor und nach spezifischer Reizung eines Auges mit einem Zwei-Photonen-Mikroskop ab, wobei diese Studie nun im Gegensatz zu früheren an wachen Tieren durchgeführt wurde. Man fand mit einer neuen Technologie, die sehr kleine Areale abbilden kann, dass Neuronen im Gehirn erwachsener Tiere, denen PSD-95 fehlt, einen verstärkten erfahrungsabhängigen Dornenabbau aufweisen, ein Effekt, der bisher nur bei jungen Tieren beobachtet wurde. Offenbar weisen Neuronen ohne PSD-95 sowohl funktionelle als auch strukturelle Merkmale der Plastizität auf, die mit einer kritischen Periode verbunden sind, sodass diese Neuronen eine Art jugendliche Fähigkeit besitzen, die Nervenzellverschaltungen, also Verbindungen zwischen Nervenzellen bis ins Erwachsenenalter umzustrukturieren.
Große Vielfalt an Synapsen
Van Oostrum et al. (2023) haben Synaptosomen von sieben verschiedenen genetisch veränderten Mauslinien mit fluoreszenzmarkierten präsynaptischen Endigungen hergestellt, wodurch man mit Hilfe der quantitativen Massenspektrometrie, einer Methode zur Identifizierung und Quantifizierung der Konzentration einzelner Proteine, 18 verschiedene Synapsentypen in fünf verschiedenen Hirnregionen. Man entdeckte dabei an die 1.800 einzigartige, an Synapsen-Typen angereicherte Proteine und ordneten Tausende von Proteinen den verschiedenen Synapsen-Typen zu, und fand damit eine erstaunliche Vielfalt von Molekülen, die den synaptischen Verbindungen zugrunde liegen. „Dies ist ein bedeutender Fortschritt in unserem Verständnis der synaptischen Vielfalt. Wenn man die komplizierte molekulare Architektur der Synapsen entschlüsselt, erweitet man nicht nur das Wissen über die Funktionsweise des Gehirns, sondern das eröffnet auch neue Wege für die Erforschung neurologischer Störungen und möglicher therapeutischer Interventionen. So wurde etwa in einer Klasse von Synapsen, die den Neurotransmitter Dopamin freisetzen, ein spezifischer Mangel an einem Molekül festgestellt, das den Zellen hilft, mit oxidativem Stress fertig zu werden.
Chemische und elektrische Synapsen
Die Kommunikation zwischen Nervenzellen geschieht im Gehirn in der Regel an Kontaktstellen zweier Nervenzellen, den Synapsen, wobei die Informationen meist in Form von chemischen Botenstoffen weitergegeben werden. Diese chemische Form der Informationsübertragung kann verstärkt oder verringert werden, abhängig davon, wie aktiv eine Nervenzelle ist. Ist ihre Aktivität sehr hoch, führt das beispielsweise dazu, dass diese auch mehr Botenstoffe an eine benachbarte Nervenzelle weitergibt, d. h., die Effektivität chemischer Synapsen wird aktivitätsabhängig angepasst. Dies ist ein andauernder Prozess, der dazu führt, dass sich chemische Synapsen ständig verändern und diese Formen der synaptischen Anpassungen spielen eine zentrale Rolle beim Lernen und der Gedächtnisbildung. An chemischen Synapsen wird daher ein elektrisches Signal zunächst in ein chemisches Signal umgewandelt, d. h., eine in der signalgebenden Nervenzelle erzeugte elektrische Entladung führt dazu, dass an der präsynaptischen Membran Neurotransmitter ausgeschüttet werden. Die meisten Synapsen sind chemische Synapsen. Bei elektrischen Synapsen erfolgt eine direkte Übertragung der Erregung durch ein elektrisches Signal. Chemische und elektrische Synapsen erfüllen im Gehirn dabei unterschiedliche Aufgaben, denn während chemische Synapsen sehr fein regulierbar sind und Botenstoffe für die Signalübertragung von einer Nervenzelle zur anderen verwenden, erlauben elektrische Synapsen, auch „gap junctions“, einen direkten Stromfluss zwischen zwei Nervenzellen und ermöglichen so eine schnellere Übertragung ohne weitreichende Verarbeitung. Der molekulare Aufbau und die Funktionsweise der elektrischen Synapsen ist zwar gut erforscht, doch die genauen Aufgaben, die sie im Gehirn übernehmen, sind jedoch im Einzelnen noch nicht endgültig geklärt. Meist wird ihnen eine modulatorische Aufgabe zugeschrieben, genauso wie eine Rolle als eine Art Pulsgeber, um neuronale Netzwerke zu synchronisieren. Durch ihr schnelles Öffnen und Schließen ermöglichen elektrische Synapsen einer Nervenzelle überdies, sich an mehreren Netzwerken zu beteiligen und erhöhen so die Verarbeitungskapazität des Gehirns. Häufig finden sich elektrische Synapsen auch in unmittelbarer Nachbarschaft zu chemischen Synapsen und regulieren so deren Wirkung. Übrigens kommen in der Netzhaut des Auges besonders viele elektrische Synapsen vor, wobei viele von ihnen unmittelbar an der Helligkeitsanpassung der neuronalen Verarbeitung beteiligt sind und bewirken, dass man sowohl im hellen Sonnenlicht als auch in der Abenddämmerung sehen kann.
Lange Zeit erschien es nicht denkbar, dass auch der zweite Typ von Synapsen im Gehirn, die elektrischen Synapsen, einen Beitrag zu Lernvorgängen leistet. Dies lag vermutlich daran, dass sowohl der Aufbau der elektrischen Synapse als auch die Art der Signalweitergabe auf dem ersten Blick vergleichsweise einfach erscheint. An elektrischen Synapsen sind zwei benachbarte Zellen direkt durch eine Art Tunnel miteinander verbunden, wobei man bisher annahm, dass diese Tunnel starre unveränderbare Strukturen sind, deren einzige Aufgabe es ist, elektrische Stromflüsse direkt von einer Zelle zur nächsten Zelle weiterzuleiten. Neuere Untersuchungen liefern nun erste Indizien, dass elektrische Synapsen sehr wohl veränderbar sind und sogar ihre Stärke aktivitätsabhängig anpassen könnten. Das bedeutet, auch bei elektrischen Synapsen kann die Stärke der synaptischen Übertragung erhöht oder verringert werden, je nachdem wie stark sie genutzt wird. Das ist eine Eigenschaft, die man zuvor nur von chemischen Synapsen kannte. Allerdings ist es sehr schwierig, den Strom, der durch die elektrischen Synapsen fließt, direkt zu messen, denn in einer Nervenzelle herrscht ein großes Durcheinander an Stromflüssen. Mit einer speziellen Messtechniken ist es dennoch möglich, die sehr kleinen Ströme, die durch eine elektrische Synapse fließen, zu erkennen und zu messen. Hierfür werden zwei mikroskopisch feine Messelektroden verwendet, dessen Spitzen um ein Vielfaches dünner sind als ein menschliches Haar. Die Kunst besteht nun darin, die fast unsichtbaren Spitzen der beiden Elektroden jeweils in das Innere der beiden verbundenen Nervenzellen einzustechen. Doch ist das erst einmal gelungen, hat man die volle Kontrolle über die Zellen. Es lässt sich beispielsweise mit Hilfe der Elektroden die Aktivität der beiden Nervenzellen gezielt herunterfahren. In diesem Ruhezustand verschwinden dann alle störenden elektrischen Signale und der Stromfluss durch eine elektrische Synapse kann durch einen Reiz ausgelöst und gemessen werden. Diese Methode ist jedoch methodisch sehr anspruchsvoll und bei sehr komplex aufgebauten Nervenzellen im Gehirn von Wirbeltieren nicht fehlerfrei anwendbar, denn zum einen sind die Zellen dort oft nur schwer zugänglich und zum anderen lässt sich aufgrund ihrer komplexen Struktur ihre elektrische Aktivität mit einer Messelektrode nicht vollständig kontrollieren. Um die Grundprinzipien des Lernens bei elektrischen Synapsen zu verstehen, verwendet man ein möglichst einfach aufgebautes Nervensystem, und zwar das Nervensystem des medizinischen Blutegels. Auch hier finden sich riesige, paarig angeordnete Nervenzellen, die sogenannten Retzius-Zellen, welche über elektrische Synapsen direkt miteinander kommunizieren. Der Vorteil dieser Zellen ist zum einen ihre Größe, wodurch sie leicht zu finden und zu untersuchen sind. Und zum anderen liegen die elektrischen Synapsen in unmittelbarer Nähe zu den Zellkörpern, wo sich die Messelektroden befinden. In zahlreichen Experimenten konnte man nun nachweisen, dass alle Messtechniken bei den Retzius-Zellen des Blutegels anwendbar und der Strom, der durch die elektrischen Synapsen zwischen den beiden Zellen hin- und her fließt, korrekt und fehlerfrei messbar ist. So zeigte sich, dass bereits eine zehn Minuten anhaltende Aktivitätsphase ausreichend ist, um die elektrische Übertragung zwischen den beiden Zellen langanhaltend zu erhöhen. Wie bei chemischen Synapsen, war auch bei den elektrischen Synapsen die beobachtete Verstärkung abhängig von der Menge an verfügbaren Kalzium-Ionen in der Zelle. Das lässt vermuten, dass die Nervenzellen in Reaktion auf ihre erhöhte Aktivität Kalzium-abhängige Prozesse in Gang setzen, die am Ende die Veränderung der elektrischen Synapsen verursachen. Möglicherweise sind es die gleichen Prozesse, die auch die Stärke chemischer Synapsen regulieren (Welzel, 2021).
Hemmprozesse am Lernen beteiligt
Bei jeder Aktivität im Gehirn werden Nervenimpulse von einer zur nächsten Nervenzelle weitergegeben, wobei oft bis zu tausend auf einer einzelnen Zelle eintreffen. Damit daraus ein präzises Signal entstehen kann, besitzt das Gehirn ein ausgeklügeltes Hemmsystem, das wie ein Filter wirkt, der nur die wichtigsten Impulse durchlässt, wodurch gezielte neuronale Muster hervortreten, die für die Speicherung im Langzeitgedächtnis unerlässlich sind. Beim Lernen oder Erinnern treffene erregende Signale an der Nervenzelle ein, wo sie in den verästelten Dendriten verarbeitet und selektiv an die nachgeschalteten Zellen weitergeleitet werden, wobei die Dendriten als effiziente Verstärker hoch präziser Signale wirken. Nach neueren Forschungen (Müller et al. , 2012) werden in ganz bestimmten Dendriten („starke Dendriten“) eingehende Signale besonders gut verstärkt werden, während an „schwachen“ Dendriten eine Weiterleitung nur in ganz bestimmten Phasen erfolgt, d.h., die Zellfortsätze sind unterschiedlich stark erregbar. Starke Dendriten leiten vor allem synchrone erregende Signale sehr präzise und verlässlich weiter, entziehen sich dabei jeglicher Hemmung und stellen so sicher, dass bestimmte, möglicherweise für Lernen und Gedächtnis besonders relevante Signale, zuverlässig weitergeleitet werden. Daraus ergeben sich klar definierte Aktivitätsmuster, die regelmäßig wiederholt werden, was zu gleichzeitiger Erregung und damit zu einer Verknüpfung bestimmter Zellgruppen führen kann, was letztlich Lernen bedeutet. Man nimmt daher an, dass diese gemeinsame neuronale Aktivität von Zellverbänden ein zelluläres Korrelat für Lernvorgänge darstellen, denn zur Speicherung von Gedächtnisinhalten im Langzeitgedächtnis müssen bestimmte Zellgruppen sehr präzise und wiederholt in der gleichen Abfolge aktiviert werden. Signale, die eine Nervenzelle über „schwache Dendriten“ empfängt, können nur in Phasen schwacher Hemmung weitergegeben werden, wobei sie sich auch verändern und zu „starken“ Dendriten werden können und dann ebenfalls zur präzisen Signalübertragung beitragen können. Diese intrinsische Plastizität macht Sinn, denn auf diese Art können Zellgruppen gekoppelt und diese Kopplung permanent gemacht werden, wobei dieser Lernmechanismus nicht wie bisher bekannt an der Synapse, sondern im Dendriten stattfindet. Dieser Mechanismus könnte vor allem in besonderen Aktivitätsphasen stattfinden, etwa wenn man etwas Neues erlebt.
Anhand mathematischer Modelle wurden die Bedingungen für die Häufung von synaptischen Kontakten zwischen Neuronen untersucht, wie sie in Experimenten beobachtetet worden waren, also unter welchen Bedingungen Synapsen gebildet oder abgebaut werden. Sind zwei Nervenzellen bereits durch mehrere Kontakte miteinander verbunden, tragen sie bekanntlich gemeinsam dazu bei, die nachgeschaltete Zelle zu erregen. Diese simultane Aktivität der einzelnen Kontakte führt schließlich dazu, dass sie kooperativ einen zusätzlichen Kontakt bilden, jedoch nur dann, wenn die beiden Nervenzellen in der richtigen Reihenfolge aktiv werden, bleibt eine Synapse bestehen. Ist das nicht der Fall, bildet sie sich zurück. Diese Reihenfolge muss offensichtlich für die einzelnen Kontakte messbar sein, wobei im Gehirn bereits Moleküle gefunden wurden, die diese Rolle eines solchen Signals spielen könnten (vgl. Deger at al., 2012).
Manche Synapsen leiten Signale mit besonders hoher Geschwindigkeit weiter, wofür nach neueren Forschungen ein Sensor zur Messung der Kalziummenge in der Nervenzelle verantwortlich ist. Verschiedene Synapsen nutzen unterschiedliche Neurotransmitter, wobei GABAergene Synapsen, die in allen Gehirnregionen und Spezies vorkommen, den Botenstoff GABA verwenden. GABAergene Synapsen kontrollieren die Aktivität in neuronalen Mikroschaltkreisen und zeichnen sich durch ihre Geschwindigkeit und Präzision aus, mit der sie Signale senden, denn zwischen Stimulation und Antwort liegen weniger als eine Millisekunde. Dass GABAergene Synapsen so schnell Signale übertragen können, liegt daran, dass in dieser Art von Synapsen der Eiweißstoff Synaptotagmin 2 als der wichtigste Sensor für die Kalziummenge in der Nervenzelle dafür verantwortlich zeichnet, dass sie ihre Signale so schnell und präzise senden können. Synaptotagmin 2 ist der wichtigste Sensor in inhibitorischen GABAergen Synapsen, während das verwandte Protein Synaptotagmin 1 das Kalzium an exzitatorischen Synapsen misst. Synaptotagmin 2 löst dabei nicht nur eine schnellere Ausschüttung des Neurotransmitters aus, sondern sorgt auch für ein schnelleres Wiederbefüllen der Bläschen mit dem Neurotransmitter, sodass die Nervenzelle schneller wieder bereit ist, ein erneutes Signal zu senden (Chen et al., 2016).
Synapsen und Lernen
Damit beim Lernen eine Information Eingang ins Gedächtnis findet, muss ein Reiz auf eine Sinneszelle treffen, und zwar in Form eines elektrischen Erregungsimpulses (Spikes) wird der Reiz an ein Neuron weitergeleitet, wobei die einzelnen Neuronen über Synapsen miteinander verbunden sind. Bei jeder neuen Information werden Synapsen neu aktiviert, d.h., wenn die Information im Gehirn verankert und damit nutzbar bleiben soll, muss sie in einer spezifischen Synapsenkombination kodiert werden. Je mehr Nervenzellen über ihre Synapsen beteiligt sind, desto stärker wird die Information im Gehirn verankert und desto besser kann sie später erinnert werden. Wird ein Reiz beim Lernen, wiederholt, so werden die bei der Informationsverarbeitung beteiligten Synapsen erneut aktiviert bzw. die Kontakte zwischen den einzelnen Neuronen verstärkt. Die häufige bzw. regelmäßige Verwendung (Wiederholung) macht die mit dieser speziellen Information befassten Netzwerke schneller und für das Gehirn wichtiger, sodass sie bei ständigem Gebrauch gegenüber anderen weniger benutzten Netzwerken bevorzugt werden. Auch und die regelmäßige Nutzung von Informationen tragen dazu bei, dass man sich besser an die Information erinnern kann. Die in weniger in Gebrauch befindlichen Strukturen gespeicherten Informationen werden zurückgedrängt, werden langsamer und für die schnellen Denkprozesse schwerer nutzbar. Dennoch gehen diese Informationen nicht vollständig verloren, jedoch wird der Zugang zu ihnen für das Gehirn schlechter auffindbar, was man allgemein als Vergessen bezeichnet, wobei diese Inhalte nie gänzlich verschwinden, sondern nur mehr schwer aus ihrem allmählich verblassenden Kontext abgerufen werden können. Ein spezielles Protein stabilisiert jene Strukturen, die Träger von wichtigen Informationen sind, sodass man auf diese Weise Unwichtiges vergessen kann, um Neues zu lernen, ohne dafür wichtige Informationen aufgeben zu müssen.
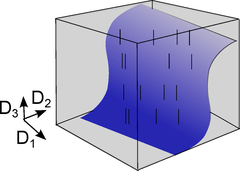 Dettner et al. (2016) haben nun im Detail untersucht, wie die Neuronen diese Spikes nutzen, um Information zu übertragen, wobei sich zeigte, dass man durch Analyse paarweise Korrelationen der Beantwortung dieser Frage einen Schritt näher kommt. In vielen Situationen genügt es nur den Raum der paarweise Korrelationen auszuwerten (blau), um die neuronale Information zu verstehen, anstatt alle Spikekombinationen betrachten zu müssen (grau). Dies sind kurze elektrische Pulse, die zu bestimmten Zeiten von einem Neuron zu einem anderen gesendet werden, wobei eine Abfolge von Spikes als Binärcode betrachtet werden kann (“1” ein Spike , “0” Abwesenheit eines Spikes). Nun stellt man sich die Frage, wie viel Information tatsächlich eine Spikeabfolge wie 00010100… enthält. Welche von den möglichen 0-1 Kombinationen sollten analysiert werden damit das Eingangssignal eines Neurons dekodiert werden kann? Vor allem letztere Frage ist nicht trivial da fast eine unendliche Anzahl Kombinationen von „0” und “1” möglich sind. Der neue theoretischen Ansatz legt nun nahe, dass nur eine begrenzte Kombinationsmenge erforderlich ist und dass Korrelationen zwischen Paaren von Spikes – zwei Zeitpunkte, an denen eine „1“ vorkommt – ausreichen, um den neuronalen Code einzelner Neurone zu knacken.
Dettner et al. (2016) haben nun im Detail untersucht, wie die Neuronen diese Spikes nutzen, um Information zu übertragen, wobei sich zeigte, dass man durch Analyse paarweise Korrelationen der Beantwortung dieser Frage einen Schritt näher kommt. In vielen Situationen genügt es nur den Raum der paarweise Korrelationen auszuwerten (blau), um die neuronale Information zu verstehen, anstatt alle Spikekombinationen betrachten zu müssen (grau). Dies sind kurze elektrische Pulse, die zu bestimmten Zeiten von einem Neuron zu einem anderen gesendet werden, wobei eine Abfolge von Spikes als Binärcode betrachtet werden kann (“1” ein Spike , “0” Abwesenheit eines Spikes). Nun stellt man sich die Frage, wie viel Information tatsächlich eine Spikeabfolge wie 00010100… enthält. Welche von den möglichen 0-1 Kombinationen sollten analysiert werden damit das Eingangssignal eines Neurons dekodiert werden kann? Vor allem letztere Frage ist nicht trivial da fast eine unendliche Anzahl Kombinationen von „0” und “1” möglich sind. Der neue theoretischen Ansatz legt nun nahe, dass nur eine begrenzte Kombinationsmenge erforderlich ist und dass Korrelationen zwischen Paaren von Spikes – zwei Zeitpunkte, an denen eine „1“ vorkommt – ausreichen, um den neuronalen Code einzelner Neurone zu knacken.
Neueste Forschung
Nach neuesten Forschungen an Mäusen sorgt das Protein Copine-6 für den Ausbau von Synapsen, sodass Signale leichter von einer Zelle zur nächsten gelangen können. Dieses Protein kommt hauptsächlich in Zellen des Hippocampus vor, jener Hirnregion, die für das Lernen und Gedächtnis wichtig ist. In einem Experiment schaltete man Copine-6 bei Mäusen gentechnisch aus, wonach die Tiere daraufhin in Lerntests viel schlechter abschnitten als die Kontrollgruppe. Danach regte man Nervenzellen künstlich an, wodurch Kalzium in die Zelle einströmte, wobei Copine-6 zur Synapse wandert und mithilfe des Kalziums an die Zellwand anbindet. Dieser Vorgang ist dabei ausschlaggebend für das Umstrukturieren des Zellskeletts und den damit einhergehenden Umbau der Synapsen, denn die Kontaktfläche zur Empfängerzelle wird dadurch grösser, die Verbindung wird gestärkt und die Signalübertragung effektiver (Reinhard et al., 2016).
Kommen die drei Proteine Teneurin, Latrophillin und FLRT (diese Proteine sind Oberflächenrezeptoren, die die Fortsätze anderer Zellen anziehen und so einen Zellverband zusammenhalten, was etwa für die Entwicklung embryonalen Gewebes wichtig ist) zusammen, verankern sie sich und halten die Zellmembranen zusammen und lösen noch weitgehend unerforschte Signalketten aus und fördern so die Synapsenbildung an dieser Stelle. Dass Teneurin und diese Partnerproteine wichtige Zellkontakte im Gehirn herstellen, ist bekannt, wobei Teneurin zudem ein evolutionsbiologisch sehr altes Protein ist, das in ähnlichen Versionen in Bakterien, Würmern, Fruchtfliegen bis hin zu Wirbeltieren vorkommt. In der Frühphase der Gehirnentwicklung führt übrigens die Interaktion dieser Proteine jedoch dazu, dass sich wandernde Nervenzellen abstoßen, denn während der Gehirnentwicklung wandern embryonale Nervenzellen in ihre Bereiche des Gehirns, wobei sie von diesen drei Proteinen zu ihrem Zielort gelenkt werden. Dies geschieht aber nicht durch Anziehung, wie bei der Synapsenbildung, sondern durch Abstoßung der Zelle (del Toro et al., 2019).
Vierunddreißig Jahre, nachdem das Nervensystem des Fadenwurms Caenorhabditis elegans im Elektronenmikroskop rekonstruiert worden war, ermöglichen nun neue elektronenmikroskopische Techniken mit hohem Durchsatz die dichte Rekonstruktion neuronaler Schaltkreise in immer größeren Gehirnvolumina mit genauer synaptischer Auflösung. Wie bei bei dem Fadenwurm besteht jedoch eine wesentliche Einschränkung für den Rückschluss auf die Gehirnfunktionen aus neuronalen Schaltplänen darin, dass nicht bekannt ist, wie die Struktur einer Synapse, die gerade untersucht wird, mit der physiologischen Übertragungsstärke zusammenhängt. Holler-Rickauer et al. (2019) haben nun Struktur und Funktion derselben Synapsen miteinander in Beziehung gesetzt, indem sie gepaarte Ganzzellaufnahmen von synaptisch verbundenen pyramidalen Neuronen in Schnitten des somatosensorischen Cortex der Maus mit korrelierter Lichtmikroskopie und hochauflösender Elektronenmikroskopie aller vermuteten synaptischen Kontakte zwischen den Neuronen kombinierten. Sie entdeckten dabei eine lineare Beziehung zwischen der Synapsengröße (Fläche der postsynaptischen Dichte) und der Synapsenstärke (Amplitude des exzitatorischen postsynaptischen Potentials), was eine experimentelle Grundlage für die Zuordnung der tatsächlichen physiologischen Gewichte zu den synaptischen Verbindungen, die in der Elektronenmikroskopie sichtbar werden, bietet. Dieser Zusammenhang kann nun genutzt werden, um an Hand der gemessenen Synapsengrößen abzuschätzen, wie stark die Informationsübertragung tatsächlich ist. Damit können etwa die Schaltkreise der Großhirnrinde mithilfe der Elektronenmikroskopie exakt kartografiert und deren Informationsfluss am Computer simuliert und interpretiert werden. Damit wurde auch die Ansicht widerlegt, dass Synapsen der Großhirnrinde pro Aktivierungsvorgang nur ein einziges Vesikel mit Botenstoffen ausschütten, sondern dass Synapsen an verschiedenen Stellen mehrere Vesikel gleichzeitig ausschütten können, also dass neocortikale Synapsen wie hippocampale Synapsen mit multivesikulärer Freisetzung arbeiten. Synapsen sind somit wesentlich komplexer und können ihre Signalstärke dynamischer regulieren als bislang vermutet, d. h., die Rechenleistung und die Speicherkapazität der gesamten Großhirnrinde ist daher wesentlich größer als bisher angenommen.
Warum haben Lebewesen überhaupt ein Gehirn?
Obwohl das Gehirn sowohl für Mensch als auch für Tier von so zentraler Bedeutung ist, sind seine Ursprünge nach wie vor nicht geklärt. Die ersten Tiergehirne entstanden vor hunderten von Millionen Jahren, wobei heute nur noch die primitivsten Tierarten, wie etwa Wasserschwämme, kein Gehirn besitzen. Nach einer Studie könnten aber gerade Schwämme zur Entschlüsselung der Geheimnisse rund um die Entstehung von Neuronen und Gehirnen liefern. Zwar besitzen Schwämme keine Synapsen, doch ihr Genom kodiert dennoch viele der synaptischen Gene, die an der neuronalen Funktion bei höheren Tieren beteiligt sind. Um die Rolle der Gene in Schwämmen zu untersuchen, wandte man im Süßwasserschwamm Spongilla lacustris mikrofluidische und genomische Technologien an, mit deren Hilfe man einzelne Zellen von mehreren Schwämmen in Tröpfchen einfing und ein Profil der genetischen Aktivität jeder Zelle erstellte. Es zeigte sich, dass bestimmte Zellen in den Verdauungskammern der Schwämme diese Gene aktivieren, d. h., selbst bei diesen einfachen Tieren ohne Synapsen sind sie also in bestimmten Teilen des Körpers aktiv. Schwämme nutzen ihre Verdauungskammern, um Nahrung aus dem Wasser zu filtern und mit Mikroben in der Umgebung zu interagieren. Als man das Verhalten der Zellen visualisierte, bildeten Zellen lange Arme aus, um bakteriellen Eindringlinge zu beseitigen. Dieses Verhalten schaffte dabei eine Schnittstelle für eine gezielte Zell-Zell-Kommunikation, wie sie auch über Synapsen zwischen Nervenzellen im Gehirn von Tieren stattfindet. Möglicherweise sind solche Zellen, die die Nahrungsaufnahme regulieren und die mikrobielle Umgebung kontrollieren, evolutionäre Vorläufer der ersten tierischen Gehirne (Musser et al., 2021).
Literatur
Chen, Chong, Arai, Itaru, Satterfield, Rachel, Young, Samuel M., Jr. & Jonas, Peter (2016). Synaptotagmin 2 Is the Fast Ca2+ Sensor at a Central Inhibitory Synapse. Cell Reports, 18, 723-736.
Deger, M. et al. (2012). Spike-Timing Dependence of Structural Plasticity Explains Cooperative Synapse Formation in the Neocortex. PLoS Comput Biol, 8:e1002689.doi:10.1371/journal.pcbi.1002689.
Dettner, A., Münzberg, S. & Tchumatchenko, T. (2016). Temporal pairwise spike correlations fully capture single-neuron information. Nature Communications, 15.
Holler-Rickauer, Simone, Köstinger, German, Martin, Kevan A. C., Schuhknecht, Gregor F. P. & Stratford, Ken J. (2019). Structure and function of a neocortical synapse. BioRxiv, doi:10.1101/2019.12.13.875971.
Keck, Tara, Scheuss, Volker, Jacobsen, R. Irene, Wierenga, Corette J., Eysel, Ulf T., Bonhoeffer, Tobias & Hübener, Mark (2011). Loss of sensory input causes rapid structural changes of inhibitory neurons in adult mouse visual cortex. Neuron, online publication, September 8 2011.
Musser Jacob M., Schippers Klaske J., Nickel Michael, Mizzon Giulia, Kohn Andrea B., Pape Constantin, Ronchi Paolo, Papadopoulos Nikolaos, Tarashansky Alexander J., Hammel Jörg U., Wolf Florian, Liang Cong, Hernández-Plaza Ana, Cantalapiedra Carlos P., Achim Kaia, Schieber Nicole L., Pan Leslie, Ruperti Fabian, Francis Warren R., Vargas Sergio, Kling Svenja, Renkert Maike, Polikarpov Maxim, Bourenkov Gleb, Feuda Roberto, Gaspar Imre, Burkhardt Pawel, Wang Bo, Bork Peer, Beck Martin, Schneider Thomas R., Kreshuk Anna, Wörheide Gert, Huerta-Cepas Jaime, Schwab Yannick, Moroz Leonid L. & Arendt Detlev (2021). Profiling cellular diversity in sponges informs animal cell type and nervous system evolution. Science, 374, 717-723.
Müller, Christina, Beck, Heinz, Coulter, Douglas & Remy, Stefan (2012). Inhibitory control of linear and supralinear dendritic excitation in CA1 pyramidal neurons. Neuron, online publication. September 5 2012.
Reinhard, Judith R., Kriz, Alexander, Galic, Milos, Angliker, Nico, Rajalu, Mathieu, Vogt, Kaspar E. & Ruegg, Markus A. (2016). The calcium sensor Copine-6 regulates spine structural plasticity and learning and memory. Nature Communications, doi:10.1038/ncomms11613.
van Oostrum, Marc, Blok, Thomas M., Giandomenico, Stefano L., tom Dieck, Susanne, Tushev, Georgi, Fürst, Nicole, Langer, Julian D., Schuman & Erin M. (2023). The proteomic landscape of synaptic diversity across brain regions and cell types. Cell, doi:10.1016/j.cell.2023.09.028.
Daniel del Toro, Maria A. Carrasquero-Ordaz, Amy Chu, Tobias Ruff*, Meriam Shahin, Verity A. Jackson, Matthieu Chavent, Miguel Berbeira-Santana, Goenuel Seyit-Bremer, Sara Brignani, Rainer Kaufmann, Edward Lowe, Rüdiger Klein, Elena Seiradake (2019). Structural basis of Teneurin-Latrophilin interaction in repulsive guidance of migrating neurons. Cell, doi:10.1016/j.cell.2019.12.014.
Welzel, G. (2021). Die unterschätzte Synapse. Spektrum.de Scilogs.
WWW: https://scilogs.spektrum.de/klartext/die-unterschaetzte-synapse/ (21-09-02)
Yusifov, Rashad, Tippmann, Anja, Staiger, Jochen F., Schlüter, Oliver M. & Löwel, Siegrid (2021). Spine dynamics of PSD-95-deficient neurons in the visual cortex link silent synapses to structural cortical plasticity. Proceedings of the National Academy of Sciences, doi:10.1073/pnas.2022701118.
http://de.wikipedia.org/wiki/Synapse (10-02-06)
http://www.idw-online.de/pages/de/news388471 (10-09-09)
http://www.meinbezirk.at/klosterneuburg/chronik/gehirn-synapse-unter-der-wissenschaftlichen-lupe-d835808.html (14-02-13)
https://www.spektrum.de/magazin/mechanische-informationsuebertragung-im-gehirn/1580866 (18-08-16)
https://www.dasgehirn.info/aktuell/frage-an-das-gehirn/waeren-wir-superschnell-haetten-wir-nur-elektrische-synapsen (16-05-21)
Bildquelle
https://brain.mpg.de//news-events/news/news/archive/2017/march/article/how-much-information-can-we-get-from-a-spike.html (17-09-11)
Great post, truly!