Die adulte Neurogenese ist die Neubildung von Nervenzellen aus bestimmten Stamm- oder Vorläuferzellen, wobei man zwischen der Neurogenese während der Embryonalentwicklung und nach der Geburt unterscheidet. Früher hielt man die Neurogenese im menschlichen, erwachsenen zentralen Nervensystem als ausgeschlossen, selbst wenn bekannt war, dass unter anderem bei einigen Singvögeln auch nach der Geschlechtsreife weiterhin Nervenzellen gebildet werden können. Bei den Vögeln spielt diese eine wesentliche Rolle beim Erlernen und Verfeinern der Paarungslieder. Allgemein ist über die Funktion neugebildeter Nervenzellen noch wenig bekannt, denn im Wesentlichen beruhen die bisherigen Aussagen auf Tiermodellen. So haben etwa Paul, Chaker & Doetsch (2017) bei der Untersuchung von Nervenzellen im Hypothalamus entdeckt, dass diese über große Distanzen in Abhängigkeit von der Nahrungszufuhr einen ganz bestimmten Typ von Stammzellen dazu stimulierten, sich zu vermehren und zu spezifischen Nervenzellen heranzureifen, im konkreten Fall zu Nervenzellen für das Riechzentrum. Sie konnten am Mausmodell auch zeigen, dass Hunger und Sättigung die Rekrutierung ganz spezifischer Stammzellpopulationen und damit verbunden, die Bildung von bestimmten Nervenzelltypen im Riechkolben steuern. Wenn die Tiere hungerten, sank die neuronale Aktivität der Nervenzellen im Hypothalamus und damit auch die Vermehrungsrate des angesteuerten Stammzellpools. Wenn die Tiere wieder Nahrung erhielten, kehrte sich dieser Prozess um.
Neuere Untersuchungen zur Neurogenese zeigen jedoch, dass es bei Menschen, wie auch bei anderen Säugetieren, zu einer Vermehrung neuronaler Stammzellen und zur Bildung neuer Nervenzellen selbst in hohem Alter kommen kann. Durch ihre Anpassungsfähigkeit und Plastizität verändern die jungen Zellen die Informationsverarbeitung in bestimmten Regionen des Gehirns wie zum Beispiel dem Hippocampus und erhöhen dadurch die Leistungsfähigkeit des Gehirns bzw. begünstigt das Belohnungssystem, das für die Dopaminausschüttung verantwortlich ist. In einer neuen Studie verglichen Moreno-Jiménez et al. (2019) Gewebeproben von neurologisch gesunden Probanden und Alzheimer-Patienten, wobei sie den Gyrus dentatus des Hippocampus in den Blick nahmen, der in früheren Studien als Ort der adulten Neurogenese identifiziert wurde. Aus Untersuchungen mit Mäusen ist bekannt, dass die Bildung neuer Nervenzellen im Gehirn in mehreren Phasen vor sich geht, wobei unausgereifte Neuroblasten eine charakteristische Abfolge von Differenzierungsschritten durchlaufen, bevor sie zu voll ausgereiften Neuronen werden. In der Reifung befindliche Nervenzellen in unterschiedlichen Differenzierungsstadien müssten sich demnach auch im menschlichen Gehirn finden lassen, was als Beweis für die adulte Neurognese gelten könnte. Im Gyrus dentatus der gesunden Erwachsenen entdeckte man tausende unreife Neuronen in unterschiedlichen Entwicklungsstadien, wobei diese neuen Nervenzellen sogar in Gewebeproben knapp 90-Jähriger vorhanden waren. Zwar scheint die Neurogenese mit zunehmendem Alter abzunehmen, doch viel stärker als das Alter wirken sich offenbar neurodegenerative Erkrankungen aus, denn die Zahl und der Reifegrad der neuen Gehirnzellen waren bei Alzheimer-Patienten deutlich verringert, d. h., je weiter die Erkrankung fortgeschritten war, desto stärker war dieser Effekt zu beobachten.
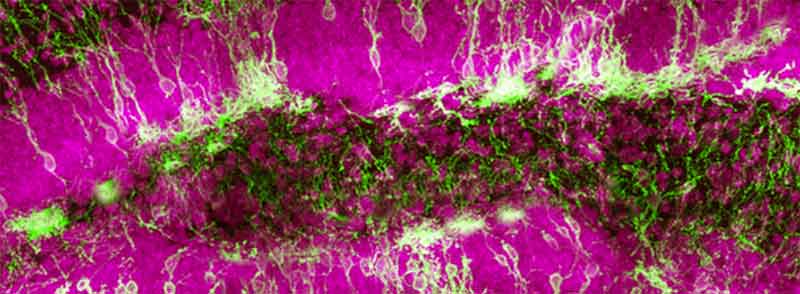
Freie Radikale sind in der bisherigen Theorie eher Abfallprodukte des normalen Stoffwechsels, wobei zelluläre Mechanismen in der Regel dafür sorgen, dass sie nicht Überhand nehmen, denn diese reaktionsfreudigen Sauerstoffverbindungen verursachen oxidativen Stress und kann Nervenschäden verursachen und Alterungsprozesse anstoßen. Adusumilli et al. (2020) haben in einer Studie den Hippocampus untersucht und am Mausmodell nachgewiesen, dass neurale Stammzellen im Vergleich zu ausgewachsenen Nervenzellen in einem hohen Maße freie Radikale enthalten, und zwar insbesondere dann, wenn die Stammzellen im Ruhezustand sind, sich also nicht teilen und nicht gerade zu Nervenzellen fortentwickeln. Ein weiterer Anstieg in der Konzentration der Radikale versetzte die Stammzellen in Teilungsbereitschaft, d. h., die Sauerstoffverbindungen wirken wie ein Schalter, der die Neurogenese in Gang setzt. Diese Ergebnisse zeigen also, dass freie Radikale für das Gehirn nicht grundsätzlich schlecht sind, sondern sorgen dafür, dass das Gehirn lebenslang anpassungfähig bleibt und gesund altern kann.
Doch keine Neurogenese im Alter?
Die gängige Lehrmeinung, dass im Hippocampus bis ins hohe Alter neue Nervenzellen gebildet werden, wird aber jetzt in einer neueren Untersuchung infrage gestellt. Sorrells et al. (2018) konnten im Gehirn von erwachsenen Menschen keine neuen Nervenzellen nachweisen, denn bei der Untersuchung des Hirngewebes von Verstorbenen und von Epilepsiepatienten, denen das Gewebe bei einer Operation entnommen worden war, versuchte man, neuronale Stammzellen mit verschiedenen Markern sichtbar zu machen. Zum Zeitpunkt der Geburt fanden sie in einer Subregion des Hippocampus noch mehr als 1600 neugebildete Zellen pro Quadratmillimeter, bei Kindern im Alter von einem Jahr waren es noch knapp 300 und mit sieben Jahren noch 12. Im Gehirn von Erwachsenen fanden sich hingegen keine mehr. Man schliesst jetzt daraus, dass die Neurogenese schon in der Kindheit rasch abnimmt und bei Erwachsenen praktisch nicht mehr vorkommt. Man vermutet nun, dass die bisherigen Studien zur Neurogenese zu fehlerhaften Ergebnissen gekommen sind.
Eine neuere Studie von Dumitru et al. (2025) lieferte jedoch wieder Belege dafür, dass selbst im reifen menschlichen Gehirn neue Nervenzellen entstehen. Fokus der Untersuchung war der Hippocampus, eine Hirnregion, die maßgeblich an Gedächtnisbildung, kognitiver Flexibilität und emotionaler Regulation beteiligt ist. Insbesondere der sogenannte Gyrus dentatus, eine Zone innerhalb des Hippocampus, erwies sich als Ort aktiver Zellneubildung. Mit modernsten molekularbiologischen Verfahren – darunter Single-Nucleus-RNA-Sequenzierung und Durchflusszytometrie – untersuchte man postmortales Gewebe von Menschen im Alter zwischen 0 und 78 Jahren. Dabei gelang es ihnen erstmals, alle Stadien neuronaler Vorläuferzellen zu identifizieren – von Stammzellen bis hin zu proliferierenden, also sich aktiv teilenden, unreifen Nervenzellen. Entscheidend war dabei der Nachweis des Zellteilungsmarkers Ki67, ergänzt durch maschinelles Lernen, das half, die feinen Unterschiede im Zellprofil zu identifizieren. Besonders aufschlussreich ist der klare Nachweis sogenannter neuronaler Progenitorzellen – jene Ursprungszellen, aus denen sich später voll funktionsfähige Neuronen entwickeln. Ihr Vorhandensein im erwachsenen Gehirn galt lange als ungeklärt und wurde oft angezweifelt. Die Studie widerlegt diese Skepsis mit methodischer Präzision und liefert so nicht nur einen wesentlichen Beitrag zur Grundlagenforschung, sondern auch zur klinischen Hoffnung: Wenn das Gehirn in der Lage ist, neue Nervenzellen zu bilden, könnten regenerative Therapieformen denkbar werden, die gezielt diese Fähigkeit aktivieren – etwa bei neurodegenerativen Erkrankungen wie Alzheimer, bei Depressionen oder anderen Störungen, die mit neuronalen Funktionsverlusten einhergehen. Bemerkenswert ist auch die individuelle Varianz, die die Forschenden beobachten konnten, denn während einige Erwachsene eine hohe Anzahl aktiver Vorläuferzellen aufwiesen, zeigten andere nur sehr geringe Mengen. Die Ursachen für diese Unterschiede sind bisher unklar, könnten jedoch sowohl genetischen Ursprungs als auch durch Umweltfaktoren wie Bewegung, Stress oder Ernährung beeinflusst sein.
Literatur
Adusumilli, Vijay S., Walker, Tara L., Overall, Rupert W., Klatt, Gesa M., Zeidan, Salma A., Zocher, Sara, Kirova, Dilyana G., Ntitsias, Konstantinos, Fischer, Tim J., Sykes, Alex M., Reinhardt, Susanne, Dahl, Andreas, Mansfeld, Jörg, Rünker, Annette E. & Kempermann, Gerd (2020). Dynamics Delineate Functional States of Hippocampal Neural Stem Cells and Link to Their Activity-Dependent Exit from Quiescence. Cell Stem Cell, doi:10.1016/j.stem.2020.10.019.
Dumitru, I., Paterlini, M., Zamboni, M., Ziegenhain, C., Giatrellis, S., Saghaleyni, R., Björklund, Å., Alkass, K., Tata, M., Druid, H., Sandberg, R., & Frisén, J. (2025). Identification of proliferating neural progenitors in the adult human hippocampus. Science, 389, 58–63.
Kempermann, Gerd (2006). Adult Neurogenesis. Stem Cells and Neuronal Development in the Adult Brain. Oxford University Press.
Moreno-Jiménez, Elena P., Flor-García, Miguel, Terreros-Roncal, Julia, Rábano, Alberto, Cafini, Fabio, Pallas-Bazarra, Noemí, Ávila, Jesús & Llorens-Martín, María (2019). Adult hippocampal neurogenesis is abundant in neurologically healthy subjects and drops sharply in patients with Alzheimer’s disease. Nature Medicine, doi:10.1038/s41591-019-0375-9.
Paul, Alex, Chaker, Zayna & Doetsch, Fiona (2017). Hypothalamic regulation of regionally distinct adult neural stem cells and neurogenesis. Science, 356, 1383-1386.
Sorrells, Shawn F., Paredes, Mercedes F., Cebrian-Silla, Arantxa, Sandoval, Kadellyn, Qi, Dashi, Kelley, Kevin W., James, David, Mayer, Simone, Chang, Julia, Auguste, Kurtis I., Chang, Edward F., Gutierrez, Antonio J., Kriegstein, Arnold R., Mathern, Gary W., Oldham, Michael C., Huang, Eric J., Garcia-Verdugo, Jose Manuel, Yang, Zhengang & Alvarez-Buylla, Arturo (2018). Human hippocampal neurogenesis drops sharply in children to undetectable levels in adults. Nature. doi:10.1038/nature25975.
Stangl, W. (2025, 5. Juli). Neue Nervenzellen im Erwachsenengehirn. Psychologie-News.
https:// psychologie-news.stangl.eu/5938/neue-nervenzellen-im-erwachsenengehirn.