Das menschliche Gehirn bildet täglich neue Erinnerungen an Ereignisse aus dem Alltag, wobei aus einer Kette von Ereignissen episodische Erinnerungen an einen räumlichen und zeitlichen Ablauf entstehen. Diese Erinnerungen speichert das Gehirn im Hippocampus als Aktivierungsmuster von Nervenzellgruppen, wobei eine entscheidende Rolle dabei Synapsen spielen, die die Nervenzellen verbinden, denn sie können ihre Stärke anpassen und sich so verändern. Der langanhaltenden Veränderbarkeit von Synapsen liegen molekularen Mechanismen zu Grunde, da bei der Gedächtnisbildung Nervenzellgruppen eine andere Funktion und eine neue Struktur erhalten, wobei bei diesem Vorgang sich die Stärke der Synapsen ändert, was als langanhaltende synaptische Plastizität bezeichnet wird. Die Theorie der synaptischen Plastizität stammt vom kanadischen Psychologen Donald O. Hebb, der mit der nach ihm benannten Regel 1949 das Lernen in neuronalen Netzwerken beschrieb: Je häufiger ein Neuron A gleichzeitig mit Neuron B aktiv ist, umso bevorzugter werden die beiden Neuronen aufeinander reagieren („neurons that fire together wire together“). Dieses Modells gilt als die neurophysiologische Grundlage von Lernen und Gedächtnis.
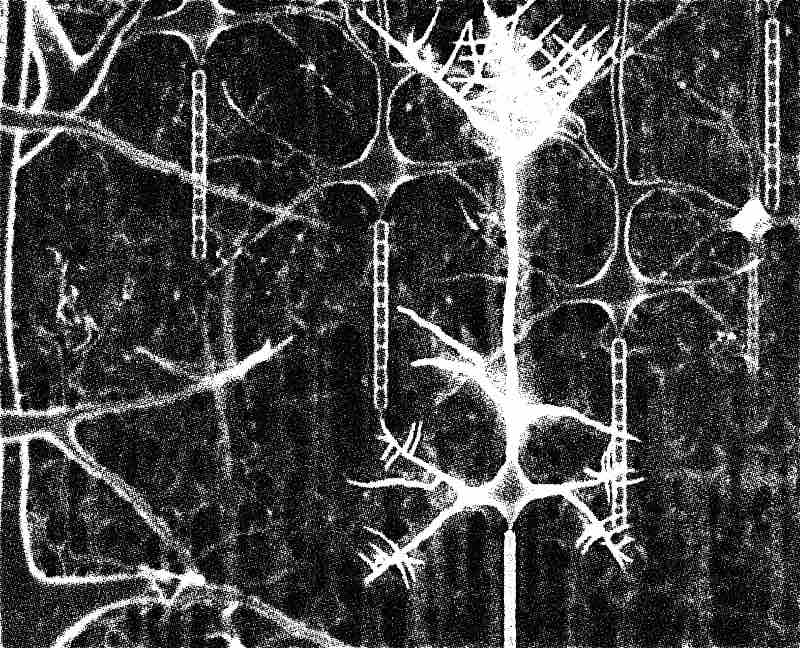 Das Gehirn eines Erwachsenen ist daher kein starr verdrahtetes Organ, sondern bis ins hohe Alter veränderbar, denn neue Erfahrungen und Eindrücke verändern die Architektur des Gehirns, bauen Verbindungen zwischen den Nervenzellen aus und lassen neue entstehen. Bekanntlich funktioniert die Reizübertragung im Nervensystem über die Synapsen, an denen ein elektrischer Impuls der präsynaptischen Nervenzelle das Freisetzen bestimmter Botenstoffe veranlasst, wodurch diese durch einen winzigen Spalt zur postsynaptischen Nervenzelle diffundieren und dort die Öffnung von Ionenkanälen bewirken, wodurch elektrischer Strom fließt und somit der Reiz weitergeleitet wird. Dabei hängt die Stärke der Reizübertragung vom Vorrat an Botenstoffen ab, von deren Freisetzungswahrscheinlichkeit und von der Amplitude des in der postsynaptischen Zelle ausgelösten elektrischen Signals. Diese synaptische Plastizität ist die Grundlage aller Umstrukturierungen im Gehirn, ohne die Gedächtnis und Lernen nicht möglich wären. Seit neueren Untersuchungen weiß man, dass sich dabei prä- und postsynaptische Veränderungen im Lauf der Zeit angleichen, dass also ein Vorrat an Botenstoffen auf der einen Seite langfristig auch mit einer größeren Andockstelle auf der anderen Seite und damit einem größeren Stromfluss einhergeht. Dabei passen sich prä- und post-synaptische Veränderungen selbst bei zehnfacher Vergrößerung oder Verkleinerung exakt aneinander an. Allerdings ist noch unklar, wie die beiden durch eine Synapse verbundenen Zellen miteinander kommunizieren, um sich miteinander abzustimmen, welche molekularen Signalwege hierfür nötig sind, und was die beobachteten Änderungen initiiert.
Das Gehirn eines Erwachsenen ist daher kein starr verdrahtetes Organ, sondern bis ins hohe Alter veränderbar, denn neue Erfahrungen und Eindrücke verändern die Architektur des Gehirns, bauen Verbindungen zwischen den Nervenzellen aus und lassen neue entstehen. Bekanntlich funktioniert die Reizübertragung im Nervensystem über die Synapsen, an denen ein elektrischer Impuls der präsynaptischen Nervenzelle das Freisetzen bestimmter Botenstoffe veranlasst, wodurch diese durch einen winzigen Spalt zur postsynaptischen Nervenzelle diffundieren und dort die Öffnung von Ionenkanälen bewirken, wodurch elektrischer Strom fließt und somit der Reiz weitergeleitet wird. Dabei hängt die Stärke der Reizübertragung vom Vorrat an Botenstoffen ab, von deren Freisetzungswahrscheinlichkeit und von der Amplitude des in der postsynaptischen Zelle ausgelösten elektrischen Signals. Diese synaptische Plastizität ist die Grundlage aller Umstrukturierungen im Gehirn, ohne die Gedächtnis und Lernen nicht möglich wären. Seit neueren Untersuchungen weiß man, dass sich dabei prä- und postsynaptische Veränderungen im Lauf der Zeit angleichen, dass also ein Vorrat an Botenstoffen auf der einen Seite langfristig auch mit einer größeren Andockstelle auf der anderen Seite und damit einem größeren Stromfluss einhergeht. Dabei passen sich prä- und post-synaptische Veränderungen selbst bei zehnfacher Vergrößerung oder Verkleinerung exakt aneinander an. Allerdings ist noch unklar, wie die beiden durch eine Synapse verbundenen Zellen miteinander kommunizieren, um sich miteinander abzustimmen, welche molekularen Signalwege hierfür nötig sind, und was die beobachteten Änderungen initiiert.
Lange hat man angenommen, dass Gedächtnisbildung vor allem an den Synapsen zwischen erregenden Nervenzellen stattfindet, doch in den vergangenen Jahren hat sich herausgestellt, dass auch Synapsen von hemmenden Nervenzellen eine entscheidende Rolle bei diesem Vorgang spielen. Eine erregende Nervenzelle aktiviert die Zelle, mit der sie über eine Synapse verbunden ist, während eine hemmende Zelle die nachfolgende Nervenzelle jedoch abschaltet. Wenn hemmende Nervenzellen bei der Gedächtnisbildung aktiviert werden, trägt dies vermutlich dazu bei, ähnliche Gedächtnisinhalte voneinander zu trennen. Wolff et al. (2014) haben in Konditionierungsexperimenten bei Mäusen nachgewiesen, dass beim Lernen hemmende Nervenzellen zumindest teilweise blockiert werden müssen, wobei diese Enthemmung dabei ähnlich wie das Loslassen des Bremspedals im Auto wirkt, denn sind die hemmenden Nervenzellen weniger aktiv, beschleunigt sich das Lernen. Die Proteine Parvalbumin und Somatostatin hemmen die Hauptnervenzellen der Amygdala, wobei beide Zelltypen während unterschiedlicher Phasen des Lernvorgangs gehemmt werden.
Strauch & Manahan-Vaughan (2019) haben nun bei Ratten gezeogt, inwieweit sich der Geruchssinn auf die Informationsverarbeitung und -speicherung im Hippocampus auswirkt bzw. die synaptische Plastizität beeinflusst. Dazu stimulierten sie den piriformen Cortex mit elektrischen Impulsen, der direkt mit einer Erhöhung der synaptischen Plastizität darauf reagierte. Die Studie liefert daher eine theoretische Grundlage dafür zu verstehen, wieso der Geruchssinn eine so besondere Rolle bei der Bildung und dem Abruf von Erinnerungen spielt.
Synapsen verarbeiten verschiedene Informationen
In Synapsen wird die elektrisch kodierte Information, die von einer Nervenzellen auf eine andere übertragen werden soll, in ein chemisches Signal übersetzt und nach der Übertragung wieder in ein elektrisches umgewandelt. Dieser Vorgang erlaubt es, dass Synapsen eine Art chemisches Gedächtnis entwickeln, indem sie eine erregende oder hemmende Wirkung erzielen, wobei diese auf molekularer Ebene ablaufenden Prozesse die Grundlage für Lernen und Gedächtnis bilden.
Die Gehirnregion um den Hippocampus ist entscheidend an der Gedächtnisbildung und ist an der Verarbeitung räumlicher Informationen beteiligt. Der Hippocampus selbst lässt sich in verschiedene Regionen unterteilen: den Gyrus dentatus, Cornu ammonis 3 und Cornu ammonis 1. Die zu verarbeitenden Informationen durchlaufen wie in einer Einbahnstraße nacheinander diese drei Regionen, wobei jede Region unterschiedliche räumliche Informationen der Umwelt verarbeitet. Eine besondere Rolle spielt hierbei Cornu ammonis 3. Sie erhält zum einen Informationen über die Moosfasern, die aus Nervenzellen des Gyrus dentatus stammen und mit den Pyramidenneuronen in Cornu ammonis 3 Kontaktstellen bilden, die Synapsen, in diesem Fall Moosfasern-Cornu ammonis 3-Synapsen. Zum anderen kommunizieren aber auch Nervenzellen aus der Cornu ammonis 3-Region sowohl derselben als auch der benachbarten Gehirnhälfte über bestimmte Fasern – die assoziativ/commissural-Fasern – auf Cornu ammonis 3-Zellen und bilden hier die assoziativ/commissural-Fasern-Cornu ammonis 3-Synapsen. Zwei Synapsen verarbeiten unterschiedliche Arten von Informationen und diese unterschiedliche Art der Informationsverarbeitung ist vermutlich dafür verantwortlich dafür, dass die Cornu ammonis 3-Region eine wichtige Rolle beim Arbeitsgedächtnis sowie bei der ‚pattern completion‘ spielt, einem Vorgang, der dazu dient, dass man eine gesamte und komplexe Erinnerung aus einem kleinen Fragment wiederherstellen kann. Auf Ebene der Nervenzellen führt die Verarbeitung von Informationen zu einer Anpassung an die Anforderungen, sind also für die synaptische Plastizität verantwortlich. Diese äußert sich in zwei Formen: als Langzeitpotenzierung (long-term potentiation), einer Verstärkung der synaptischen Übertragung, und als Langzeitdepression (long-term depression), einer Abschwächung der synaptischen Übertragung. Sowohl long-term potentiation als auch long-term depression codieren dabei verschiedene Arten von räumlichen Informationen. Dabei spielt der metabotrope Glutamat 5-Rezeptor (mGlu5-Rezeptor) eine bedeutende Rolle bei der lang anhaltenden Form der synaptischen Plastizität (Hagena & Manahan-Vaughan, 2015).
[Quelle: www.youtube.com/EGKTH60rvoU]
Beispiel für die synaptische Plastizität
Bei einem großflächigen operativen Eingriff, einer Lobektomie, entfernten Ärzte bei einem von Epilepsie und einem großen Tumor betroffenen sechsjährigen Kind unter anderem den Okzipitallappen, der auch die Sehrinde beherbergt und für die Verarbeitung von visuellen Reizen zuständig ist. Zudem wurde ein Großteil des Temporallappens entnommen, der für Funktionen des Hörens, der Sprache und des Gedächtnisses wichtig ist, während die linke Gehirnhälfte intakt blieb. Nach der Operation untersuchte man drei Jahre lang, wie sich das Gehirn und die Fähigkeiten des Jungen entwickelten, wobei die linke Gehirnhälfte nach drei Jahren einige Aufgaben der rechten übernommen hatte. Konkret konnte das Kind Gesichter und Objekte erkennen, allerdings kann er die linke Hälfte des normalen Blickfelds nicht sehen, was er aber durch einfaches Drehen des Kopfes ausgleichen kann. Diese Ergebnisse zeigen deutlich die Plastizität der Gehirnentwicklung bei Kindern. Eine Besonderheit war, dass es offenbar nicht zum Crowding gekommen ist, das auftreten kann, wenn eine Gehirnhälfte im Zuge der Reorganisation weitere Funktionen übernimmt. So kann etwa die Übernahme von Funktionen der Sprache durch die rechte Hirnhemisphäre dazu führen, dass gleichzeitig visuell-räumliche Funktionen beeinträchtigt werden.
Die Auslösung von synaptischer Plastizität erfordert das Vorhandensein zeitlich neuronaler Aktivitätsmuster, wobei zahlreiche Studien schon gezeigt haben, dass die Langzeitpotenzierung, also die Fähigkeit der Gehirnzellen die Kommunikationsstärke zwischen einzelnen Nervenzellen zu verändern, durch hochfrequente intermittierende Stimulation hervorgerufen werden kann. Beim Menschen können Plastizitätsprozesse, die dem Wahrnehmungslernen durch Übung und Wiederholung zugrunde liegen, durch wiederholte ähnliche sensorische Stimulation zuverlässig induziert werden. Das führt in der Folge zu einer Verbesserung der Wahrnehmungsfähigkeiten parallel zur weit verbreiteten Remodellierung der cortikalen Verarbeitung. Reizt man beispielsweise über längere Zeit die Fingerspitze mit einem wiederholten Tastimpuls, verbessert sich der Tastsinn nachweislich. Brickwedde et al. (2020) haben nun vermutlich auch gezeigt, was dabei im Gehirn passiert. Dabei registrierte man mithilfe eines Enzephalogramms die Aktivität der Nervenzellen in den für die Verarbeitung solcher Impulse zuständigen Hirnbereiche (somatosensorischer Cortex) und konnte darstellen, dass sich die Aktivität der dortigen Nervenzellen vermutlich als Abbildung dieses Lernprozesses verändert. Durch die elektrophysiologischen Messungen der Gehirnaktivität konnte man demnach zeigen, dass sich in aktiven Stimulationsphasen große Zellensembles in ihrer Aktivität an die Frequenz der Stimulation anpassen, wobei diese Reaktion über zwanzig Minuten hinweg ohne Zeichen von Gewöhnung konstant blieb, ganz ähnlich wie bei zellulärer Langzeitpotenzierung. Danach war die ereigniskorrelierte Desynchronisierung dieses Alpha-Rhythmus, eine typische Reaktion auf Tastreize, nach 20 Minuten wieder verringert.
Kurioses
Dass im Schlaf auf molekularer Ebene im menschlichen Gehirn die allgemeine Verbindungsstärke von Synapsen auch verringert wird, dass also einige dieser Verbindungen geschwächt und manche sogar ganz abgebaut werden, führte in einem populärwissenschaftlichen Magazin zu der kuriosen Überschrift: „Nachts, wenn die Synapsen welken“.
Literatur
Brickwedde, Marion, Schmidt, Marie D., Krüger, Marie C. & Dinse Hubert R. (2020). 20 Hz steady-state response in somatosensory cortex during induction of tactile perceptual learning through LTP-like sensory stimulation. Frontiers in Human Neuroscience, 14, doi:10.3389/fnhum.2020.0025.
Hagena, H. & Manahan-Vaughan, D. (2015). mGlu5 acts as a switch for opposing forms of synaptic plasticity at mossy fiber-CA3 and commissural associational-CA3 Synapses. The Journal of Neuroscience, DOI: 10.1523/JNEUROSCI.3417-14.2015
Hainmüller, T., Krieglstein, K., Kulik A. & Bartos, M. (2014). Joint CP-AMPA and group I mGlu receptor activation is required for synaptic plasticity in dentate gyrus fast-spiking interneurons. PNAS. doi: 10.1073/pnas.1409394111er
Loebel, Alex, Le Bé, Jean-Vincent, Richardson, Magnus, Markram, Henry & Herz, Andreas (2013). Matched Pre- and Post-Synaptic Changes Underlie Synaptic Plasticity Over Long Time Scales. Journal of Neuroscience, in press; doi: 10.1523/JNEUROSCI.3740-12.2013.
Steffen B. E. Wolff, Jan Gründemann, Philip Tovote, Sabine Krabbe, Gilad A. Jacobson, Christian Müller, Cyril Herry, Ingrid Ehrlich, Rainer W. Friedrich, Johannes J. Letzkus & Andreas Lüthi (2014). Amygdala interneuron subtypes control fear learning through disinhibition. Nature.
Strauch, Christina & Manahan-Vaughan, Denise (2019). Orchestration of Hippocampal Information Encoding by the Piriform Cortex. Cerebral Cortex, doi:10.1093/cercor/bhz077.